Słynny wiersz Samuela Coleridge’a „Rymy o sędziwym marynarzucytowano: „Woda, woda, wszędzie i ani kropli do picia!” Za pomocą tych słynnych wersów Coleridge wskazał, że nie ma wody do spożycia, mimo że otacza go ocean. Wspomniał też, że zabił albatrosa (co według miejscowej tradycji przynosi pecha wszystkim na statku). Oczywiście swoimi słynnymi wersami potwierdza także powszechną wiedzę, że 75% powierzchni Ziemi zajmuje woda. Dodatkowo wiemy również, że 60% ludzkiego ciała składa się z wody. Zatem woda (prosta cząsteczka) okazuje się kluczowa we wszystkich procesach.
Aby uczniowie mogli dowiedzieć się więcej o tym znanym zjawisku (szczegółowo), nauczyciele chemii w college’u zadają prace domowe dotyczące właściwości chemicznych H2O, jego struktury, znaczenia dla środowiska itp., aby określić ich głębokość zrozumienia. Jednakże studenci, którzy nie mają pewności co do właściwości chemicznych, struktury i ogólnego znaczenia, często mają trudności z przygotowaniem dobrze udokumentowanych i unikalnych prac w krótkim terminie. Na szczęście istnieje kilka godnych uwagi stron internetowych z korepetycjami za zadania (np Najlepszy pomocnik w odrabianiu zadań domowych) oferują 360-stopniową pomoc w odrabianiu zadań domowych z chemii, zarówno na tematy podstawowe, jak i zaawansowane.
Ich dostosowane do indywidualnych potrzeb korepetycje umożliwiają uczniom poszerzenie wiedzy przedmiotowej/koncepcyjnej, udoskonalenie umiejętności pisania akademickiego i przygotowanie prac godnych przesłania, aby uzyskać doskonałe oceny. Możesz go wypróbować, jeśli masz podobne trudności ze zrozumieniem konkretnych tematów z chemii zawartych w programie nauczania.
Niemniej jednak poniżej wyjaśniamy wszystko w sposób przejrzysty, aby pomóc Ci rozpocząć pracę domową.
Właściwości chemiczne wody
Będąc substancją chemiczną, (H2O) reaguje z wieloma substancjami, tworząc różne związki chemiczne.
Reakcja redoks: Jako wspaniałe źródło wodoru (posiadającego 2 atomy wodoru związane kowalencyjnie z jednym atomem tlenu), pierwiastki elektrododatnie zmniejszają cząsteczki wodoru.
Podczas fotosyntezy H2O ulega redukcji i utlenieniu do O2, co jest niezbędne w reakcjach redoks. (Zobacz przykład)
![]()
Z natury klimatyczny: Wielu może wiedzieć, że H2O może służyć jako zasada i kwas. Oznacza to, że z natury jest atmosferyczny. (Zobacz przykład)
Zachowanie kwaśne:
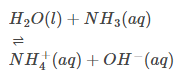
Podstawowe zachowanie:
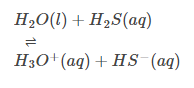 Reakcja hydrolizy: Ma również silną tendencję do nawilżania, głównie ze względu na swoją stałą dielektryczną i może rozpuścić kilka kultowych związków. Niektóre związki jonowe i kowalencyjne mogą ulegać hydrolizie.
Reakcja hydrolizy: Ma również silną tendencję do nawilżania, głównie ze względu na swoją stałą dielektryczną i może rozpuścić kilka kultowych związków. Niektóre związki jonowe i kowalencyjne mogą ulegać hydrolizie.
Bezpieczne pomoc w odrabianiu zadań domowych na studiach z TopHomeworkHelper.com i uzyskaj bezpłatny dostęp do licznych rozwiązań z zakresu chemii/pisanie notatek.
Więcej o właściwościach H2O
- Masa cząsteczkowa – 8,01528(33) g/mol
- Gęstość ciała stałego – 0,9167 g/ml w temperaturze 0°C
- Gęstość cieczy – 0,961893 g/ml w 95°C, 0,9970474 g/ml w 25°C, 0,9998396 g/ml w 0°C
- Temperatura topnienia – 0 stopni C
- Temperatura wrzenia – 100 stopni C
- Kwasowość – 13,995
- Prężność pary – 0,032176 atm/3,1690 kilopaskali
- Lepkość – 0,890 cP
- Przewodność cieplna –0,6065 W/m·K
- Współczynnik załamania światła – 1,3330 (nD)
- Zasadowość – 13,995 (pKb)
Chemia Struktury Wody
Struktura chemiczna wody to 2 różne atomy wodoru połączone z jednym atomem tlenu. Ze względu na wyższą elektroujemność atomów tlenu posiada polarne wiązania kowalencyjne. Atom tlenu w większym stopniu niż atomy wodoru przyciąga wspólne elektrony wiązań kowalencyjnych. W związku z tym atomy tlenu zostają naładowane ujemnie (częściowo), podczas gdy atomy wodoru otrzymują częściowy ładunek dodatni. Atomy przyjmują następnie wygiętą strukturę z powodu 2 samotnych par elektronów na atomie tlenu. Wygięty kształt cząsteczki wody wynika z tego, że polarne wiązania O – H nie znoszą się wzajemnie, a cała cząsteczka jest polarna.
Co więcej, wiązania polarne przyciągają się wzajemnie poprzez siły dipol-dipol (dodatni koniec jednej cząsteczki zostaje przyciągany do ujemnego końca pobliskiej cząsteczki). W wodzie polarne wiązania O – H mają niewielką gęstość elektronową w pobliżu atomów wodoru, przy czym każdy atom H2 jest przyciągany przez samotne elektrony na sąsiednim atomie O. Nazywa się to wiązaniami wodorowymi i są one silniejsze niż jakiekolwiek normalne siły dipol-dipol.
Znaczenie dla środowiska
W obliczu corocznego wzrostu liczby ludności na świecie, rośnie także znaczenie środowiskowe i zapotrzebowanie na wodę użytkową.
Woda jest również ważna dla karmienia, uprawy i pielęgnacji różnych roślin i zwierząt (nawet przemieszczania się i hodowli ryb). Rutynowe podlewanie roślin kwitnących zapewnia również pożywienie i schronienie owadom, gadom, żabom i ssakom. Nawet ptaki leśne dobrze reagują na zdrowe tereny podmokłe. Mogą łatwo żerować i przemieszczać się, aby zapylać rośliny i regulować owady i szkodniki.
Społeczeństwo musi w większym stopniu docenić wartość wody. Czysta woda ma kluczowe znaczenie dla rolnictwa, hodowli zwierząt, warunków sanitarnych i utrzymania otaczającego ekosystemu. Woda pomaga przywrócić i utrzymać naturalny przepływ w rzekach, terenach podmokłych, potokach itp. oraz pomaga w utrzymaniu siedlisk na terenach zalewowych.
Dlatego ważne jest, aby rząd światowy i inne oficjalne organy odpowiedzialne za utrzymanie zdrowego, odnawialnego i odpornego systemu wodnego z korzyścią dla wszystkich.
Source: Chemia wody: właściwości, struktura i znaczenie dla środowiska